1. 연쇄반응의 정의
연쇄반응은 연소 과정에서 발생하는 화학 반응이 연속적으로 이어지며 에너지를 방출하는 과정입니다. 주로 자유 라디칼(Free Radicals)이 생성되고, 이들이 또 다른 화학 반응을 유도하면서 연쇄적으로 반응이 이어집니다.
2. 자유 라디칼의 역할
자유 라디칼은 전자가 부족하여 매우 반응성이 높은 화학종입니다. 연소 과정에서 이들이 중심적인 역할을 합니다.
- 주요 자유 라디칼: H, OH, O
- 자유 라디칼은 연소 반응을 가속화하고, 새로운 라디칼을 생성하여 연쇄 반응을 유지합니다.
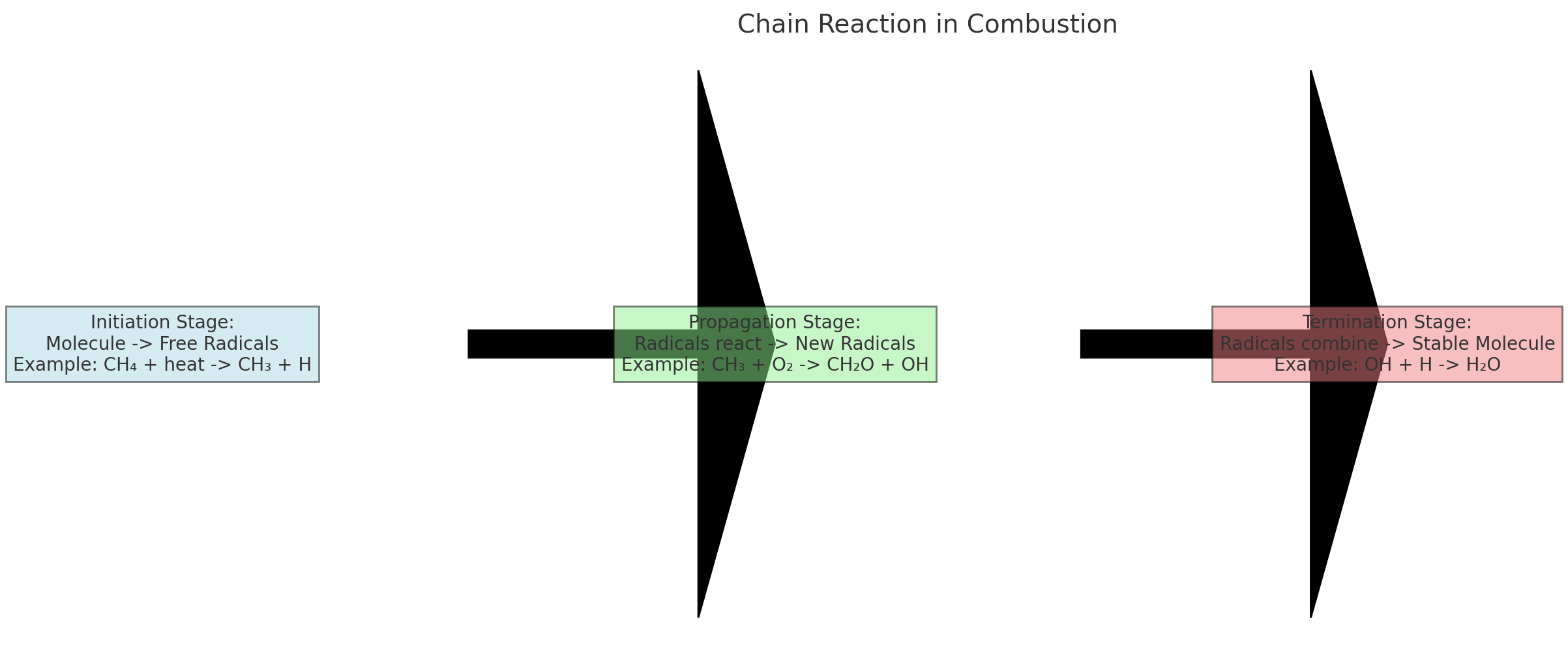
3. 연쇄반응의 단계
연쇄반응은 네 가지 주요 단계로 구분됩니다.
3.1 개시 단계(Initiation)
- 열이나 불꽃 등의 에너지로 인해 연료 분자가 분해되어 자유라디칼이 생성됩니다
- 예: RH → R· + H· (R은 탄화수소 분자, ·은 자유라디칼을 의미)
3.2 전파 단계(Propagation)
- 생성된 자유라디칼이 다른 연료 분자와 반응하여 새로운 자유라디칼을 만듭니다
- R· + O₂ → ROO·
- ROO· + RH → ROOH + R·
3.3 분지 단계(Branching)
- 하나의 자유라디칼이 여러 개의 새로운 자유라디칼을 생성합니다
- ROOH → RO· + ·OH
- 이 단계에서 반응이 급격히 가속화됩니다
3.4 종결 단계(Termination)
- 자유라디칼들이 서로 결합하여 안정한 생성물이 됩니다
- R· + R· → R-R
- ROO· + R· → ROOR
4. 연쇄반응의 특징
1. 에너지 방출 : 라디칼 반응은 연소 에너지를 방출하며, 이 에너지가 연소를 지속시키는 열원이 됩니다.
2. 가속 효과 : 라디칼이 증가하면서 연소 속도가 급격히 빨라집니다.
3. 반응의 불안정성 : 연쇄반응이 갑작스럽게 멈추거나 폭발적으로 진행될 수 있습니다.
5. 연쇄반응 억제 방법
5.1. 라디칼 제거
- 화학적으로 라디칼을 비활성화시킵니다.
- 예: 할론(Halon) 소화제는 \(\cdot OH\) 라디칼과 반응하여 연소를 억제합니다.
5.2. 냉각
- 연소 온도를 낮춰 라디칼 생성 속도를 줄입니다.
5.3. 질식
- 산소 농도를 낮추어 연쇄 반응이 일어날 조건을 없앱니다.
6. 연쇄반응 예
6.1. 가스 연소
- 메탄(\(CH_4\))과 산소(\(O_2\))의 연소는 전형적인 연쇄반응입니다.
6.2. 폭발
- 화학적 폭발은 연쇄반응이 매우 빠르게 진행될 때 발생합니다.
6.3. 화재 초기 확산
- 초기 화재 단계에서는 연쇄반응이 주도하여 화염이 빠르게 퍼집니다.
7. 소방과 연쇄반응
소방에서는 연쇄반응 억제가 매우 중요합니다. 특히 화학적 소화제는 라디칼을 제거하여 연쇄반응을 차단함으로써 효과적으로 화재를 진압합니다. 예를 들어:
- 이산화탄소(CO₂)는 연쇄반응을 직접 억제하지는 않지만 냉각과 질식 효과로 라디칼 생성을 방해합니다.
- 할론은 연쇄반응을 직접 차단하여 화재를 빠르게 진압합니다.
연쇄반응은 연소의 지속성과 확산을 이해하는 핵심 원리입니다. 이를 바탕으로 화재 예방과 진압 방법을 더 깊이 연구할 수 있습니다
'소방기술사' 카테고리의 다른 글
| 물의 표면장력 (Surface tension of water) (2) | 2025.01.07 |
|---|---|
| 습식 스프링클러 (Wet Pipe System) (1) | 2025.01.04 |
| 연돌효과 (Stack Effect) (0) | 2025.01.02 |
| 열방출률 HRR(Heat Release Rate) (0) | 2025.01.01 |
| 오리피스 (Orifice) (1) | 2024.12.02 |



